Στην ενότητα της ορυκτολογικής περιγραφής του διαμαντιού, μπορεί κανείς να θαυμάσει τους τρόπους με τους οποίους η φύση έχει προικίσει αυτόν τον κρύσταλλο. Στην επόμενη ενότητα που περιγράφει τις συνθήκες γέννησής του, κατανοούμε έστω και εν μέρει τις πολύπλοκες διεργασίες που επιστρατεύει ο εσωτερικός μηχανισμός της γης για να φέρει στην επιφάνεια τον αδιαφιλονίκητο αυτοκράτορα των πολύτιμων λίθων.
Εάν επιστρέψουμε όμως στην ενότητα «Η χρησιμότητα του διαμαντιού στην επιστήμη», θα δούμε ότι το διαμάντι δεν είναι η μόνη κρυσταλλική μορφή του άνθρακα. Υπάρχει κι άλλο ένα ορυκτό που συνίσταται κι αυτό αποκλειστικά και μόνο από άνθρακα, ο γραφίτης.
Στην ορυκτολογία υπάρχουν οι όροι πολυμορφισμός και πολύμορφα ορυκτά. Ο πολυμορφισμός είναι η ικανότητα μιας χημικής ένωσης να κρυσταλλώνεται με διαφορετική συμμετρία, ανάλογα με τις συνθήκες πίεσης και θερμοκρασίας (P/T). Μπορεί δηλαδή, ανάλογα με την ενέργεια που διαθέτει, να σχηματίζει διαφορετικά κρυσταλλικά πλέγματα. Στον κόσμο των κρυστάλλων υπάρχουν πάρα πολλά τέτοια παραδείγματα:
- Το ανθρακικό ασβέστιο CaCO3: κρυστάλλωση στο τριγωνικό κρυσταλλογραφικό σύστημα γνωστή ως ασβεστίτης ή κρυστάλλωση στο ρομβικό κρυσταλλογραφικό σύστημα γνωστή ως αραγωνίτης.
- Το διοξείδιο του πυριτίου SiO2: κρυστάλλωση στο τριγωνικό κρυσταλλογραφικό σύστημα γνωστή ως χαλαζίας ή κρυστάλλωση στο τετραγωνικό κρυσταλλογραφικό σύστημα γνωστή ως χριστοβαλίτης.
- Ο θειούχος σίδηρος FeS2: κρυστάλλωση στο κυβικό κρυσταλλογραφικό σύστημα γνωστή ως σιδηροπυρίτης ή κρυστάλλωση στο ρομβικό κρυσταλλογραφικό σύστημα γνωστή ως μαρκασίτης.
- Ο άνθρακας C: κρυστάλλωση στο κυβικό κρυσταλλογραφικό σύστημα ως διαμάντι ή κρυστάλλωση στο εξαγωνικό κρυσταλλογραφικό σύστημα γνωστή ως γραφίτης.
Τα πολύμορφα ορυκτά μπορεί να έχουν ελάχιστες διαφορές μεταξύ τους σε ό,τι αφορά την εξωτερική εμφάνιση και τις φυσικές τους ιδιότητες, π.χ. ο σιδηροπυρίτης με τον μαρκασίτη έχουν σχεδόν ίδιες τιμές στις φυσικές τους ιδιότητες, είναι και τα δύο μεταλλικά ορυκτά και απλώς διαφέρουν στη συμμετρία. Ο αραγωνίτης και ο ασβεστίτης έχουν κι αυτά παρόμοιες τιμές στη σκληρότητα και στο ειδικό βάρος, με διαφορά στη συμμετρία τους. Υπάρχει όμως κι άλλη περίπτωση, τα δύο πολύμορφα να μην έχουν καμία σχέση μεταξύ τους, ούτε στην εμφάνιση αλλά ούτε και στις τιμές των φυσικών τους ιδιοτήτων. Μια τέτοια περίπτωση είναι το διαμάντι με τον γραφίτη. Το ένα έχει τις υψηλότερες τιμές σε όλες τις φυσικές ιδιότητες με πλήρη διαφάνεια, ενώ το άλλο έχει τις χαμηλότερες τιμές και είναι αδιαφανές και μεταλλικό.
Το διαμάντι έχει τη μέγιστη σκληρότητα 10, ο γραφίτης τις ελάχιστες τιμές 1 με 2. Το διαμάντι έχει ειδικό βάρος (ε.β.) 3,52 ενώ ο γραφίτης 2,23. Το διαμάντι απαντά στη φύση με καλοσχηματισμένους διάφανους και λαμπερούς κρυστάλλους, ο γραφίτης σπάνια απαντά με κρυστάλλους ενώ είναι αδιαφανής με σκούρο φαιό χρώμα. Είδαμε πιο πάνω ότι η πολυμορφία είναι η ικανότητα μιας χημικής ένωσης να μπορεί να κρυσταλλωθεί σε διαφορετικές ενεργειακές καταστάσεις, που εκφράζονται με διαφορά στη συμμετρία των κρυστάλλων. Δηλαδή, άλλη ενέργεια έχουν τα ιόντα σε υψηλές θερμοκρασίες και χαμηλές πιέσεις, και άλλη ενέργεια έχουν τα ίδια ιόντα σε χαμηλές θερμοκρασίες και υψηλές πιέσεις. Στην πρώτη περίπτωση η στοιχειώδης κυψελίδα θα είναι πιο χαλαρή, διότι τα ιόντα λόγω των υψηλών θερμοκρασιών θα εκτελούν ταλάντωση με μεγάλη συχνότητα, ενώ στις υψηλές πιέσεις η στοιχειώδης κυψελίδα θα είναι περιορισμένη και δυσκίνητη.
Όταν μεταβληθούν οι συνθήκες (P/T), τότε το ένα πολύμορφο μπορεί να μετατραπεί στο άλλο. Δηλαδή ο χαλαζίας, όταν αυξάνεται η θερμοκρασία, μετασχηματίζεται σε χριστοβαλίτη, και το αντίστροφο.
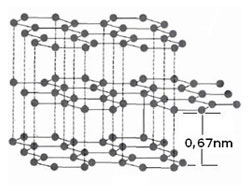
Σχήμα 1.
Η μετατροπή από το ένα πολύμορφο στο άλλο γίνεται με τρεις τρόπους: με ανακατασκευή της κρυσταλλικής δομής, με μετατόπιση των κρυσταλλογραφικών κόμβων και με αναδιάταξη της κρυσταλλικής δομής. Ο πρώτος τρόπος, της ανακατασκευής της κρυσταλλοδομής, γίνεται με διάλυση της υπάρχουσας δομής και επανακρυστάλλωσης με εντελώς διαφορετική συμμετρία. Σπάνε δηλαδή οι δεσμοί της στοιχειώδους κυψελίδας και δημιουργούνται νέες δυνάμεις, με επαναδιάταξη των ατόμων ή των ιόντων στο χώρο. Όπως καταλαβαίνουμε, αυτό δεν είναι απλή διαδικασία, χρειάζονται μεγάλα ποσά ενέργειας και χρόνου. Αντίθετα στους άλλους δύο τρόπους δεν χρειάζεται μεγάλη αύξηση της ενέργειας και δεν συμβαίνει σπάσιμο των χημικών δεσμών, ούτε και διάλυση της κρυσταλλικής δομής.
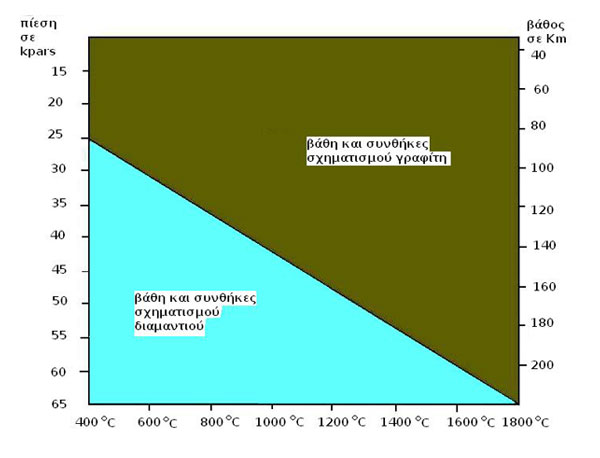
Θα λέγαμε πως η ύπαρξη ελεύθερου άνθρακα στη λιθόσφαιρα οδηγεί σε κρυστάλλωση γραφίτη, ενώ η παρουσία ελεύθερου άνθρακα στον μανδύα οδηγεί σε κρυστάλλωση διαμαντιού. Διότι το μικρότερο βάθος εντός της γης που δύναται να κρυσταλλωθεί το διαμάντι είναι τα 100 χιλιόμετρα βάθος, από εκεί και πάνω η μόνη μορφή του κρυσταλλικού άνθρακα είναι ο γραφίτης.
Τώρα σίγουρα μας δημιουργείται η εξής απορία: πώς είναι δυνατόν το διαμάντι να παραμένει διαμάντι καθώς ανεβαίνει στην επιφάνεια, εφόσον σε χαμηλές πιέσεις και θερμοκρασίες μικρότερες από 400˚C, η σταθερή κρυσταλλική μορφή του άνθρακα είναι ο γραφίτης; Αλλά κι αν ακόμα υποθέσουμε ότι φτάσει στην επιφάνεια, γιατί με την πάροδο του χρόνου δεν μετασχηματίζεται σε γραφίτη;
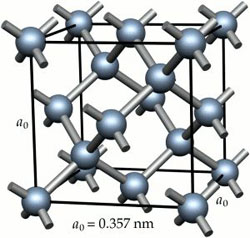
Σχήμα 3.
Είδαμε πιο πάνω τους τρόπους που το ένα πολύμορφο δύναται να μετασχηματιστεί σε ένα άλλο. Από ό'τι έχουμε καταλάβει, δεν είναι εύκολο η παντοδύναμη κρυσταλλοχημική δομή του διαμαντιού (σχήμα 3) να μεταπέσει στη χαλαρή γραφιτική δομή χωρίς να σπάσουν οι δεσμοί μεταξύ των ατόμων του άνθρακα. Επομένως, τα πολύμορφα του άνθρακα εναλλάσσονται με ανακατασκευή του κρυσταλλικού πλέγματος. Όπως αναφέρεται και παραπάνω, αυτό απαιτεί υψηλά ποσά ενέργειας και χρόνο. Στο κεφάλαιο της γέννησης των διαμαντιών πληροφορηθήκαμε ότι η άνοδος του κιμπερλιτικού μάγματος είναι γρήγορη, οπότε και αποτρεπτική για τον μετασχηματισμό σε γραφίτη. Εφόσον φτάνει στην επιφάνεια ως διαμάντι και όχι ως γραφίτης, μετά χρειάζεται ανακατασκευή του κρυσταλλικού πλέγματος και σπάσιμο των ομοιοπολικών δεσμών του άνθρακα. Μάθαμε όμως ότι ο ομοιοπολικός δεσμός είναι πολύ ισχυρός χημικός δεσμός και για να «σπάσει», απαιτείται μεγάλη ενέργεια. Η ενέργεια αυτή είναι 3kJ, ίση περίπου με την ενέργεια που καταναλώνει ένας θερμοσίφωνας, η πιο σπάταλη ενεργειακά ηλεκτρική συσκευή ενός σπιτιού. Ουσιαστικά δηλαδή τα διαμάντια είναι σταθερά στις συνθήκες επιφανείας, και δεν γίνεται να μετασχηματιστούν σε γραφίτη με φυσικά αίτια.
Αυτό κάνει τα διαμάντια ακόμα πιο αξιοθαύμαστα, διότι παρά το ότι προέρχονται από υψηλότατες πιέσεις και θερμοκρασίες, μένουν ανεπηρέαστα σε σχεδόν οποιεσδήποτε συνθήκες, εφόσον για το μετασχηματισμό τους απαιτείται μεγάλο ποσό ενέργειας. Δηλαδή η φύση δημιουργεί έναν μοναδικό κρύσταλλο, μέσω ακραίων συνθηκών, που μπορεί όμως και μένει απαθής εκτός του φυσικού του περιβάλλοντος. Φανταστείτε ένα ζώο που ζει στα αβυσσικά βάθη των ωκεανών, να είχε την δυνατότητα να διαβιώνει ως κατοικίδιο στο σπίτι μας!
Βιβλιογραφία
Introduction to Mineral Sciences - Andrew Putnis
Manual of Mineralogy - J.D. Dana (21η έκδοση)
An Introduction to the Rock-Forming Minerals - Deer, Howie & Zussman (2η έκδοση)


 © 2016 - 2024. All Rights Reserved
© 2016 - 2024. All Rights Reserved




